
เวเลนซ์อิเล็กตรอน
 ในทางเคมี คือ อิเล็กตรอนที่อยู่ในวงโคจรชั้นนอกสุดของอะตอม อิเล็กตรอนเหล่านี้จะมีส่วนร่วมในปฏิกิริยาเคมีด้วย ธาตุที่มีอิเล็กตรอนชั้นนอกสุดเต็มมักจะไม่ไวต่อปฏิกิริยา ส่วนธาตุที่มีอิเล็กตรอนชั้นนอกสุดเกือบเต็มหรือเกือบว่างเช่นโลหะอัลคาไลและแฮโลเจนจะมีความไวต่อปฏิกิริยา ในทางเคมี คือ อิเล็กตรอนที่อยู่ในวงโคจรชั้นนอกสุดของอะตอม อิเล็กตรอนเหล่านี้จะมีส่วนร่วมในปฏิกิริยาเคมีด้วย ธาตุที่มีอิเล็กตรอนชั้นนอกสุดเต็มมักจะไม่ไวต่อปฏิกิริยา ส่วนธาตุที่มีอิเล็กตรอนชั้นนอกสุดเกือบเต็มหรือเกือบว่างเช่นโลหะอัลคาไลและแฮโลเจนจะมีความไวต่อปฏิกิริยา
 การหาจำนวนเวเลนซ์อิเล็กตรอน การหาจำนวนเวเลนซ์อิเล็กตรอน
 การหาปริมาณเวเลนซ์อิเล็กตรอนของธาตุที่มี วิธีหนึ่งก็ดูที่ หมู่ธาตุ (ในตารางภาพ) ที่ซึ่งธาตุเรียงอยู่ ยกเว้น หมู่ 3-12 (โลหะทรานซิชั่น-transition metals) ตัวเลขในคอลัมน์ขวาสุดคือจำนวน เวเลนซ์อิเล็กตรอน ของธาตุในหมู่นั้น การหาปริมาณเวเลนซ์อิเล็กตรอนของธาตุที่มี วิธีหนึ่งก็ดูที่ หมู่ธาตุ (ในตารางภาพ) ที่ซึ่งธาตุเรียงอยู่ ยกเว้น หมู่ 3-12 (โลหะทรานซิชั่น-transition metals) ตัวเลขในคอลัมน์ขวาสุดคือจำนวน เวเลนซ์อิเล็กตรอน ของธาตุในหมู่นั้น
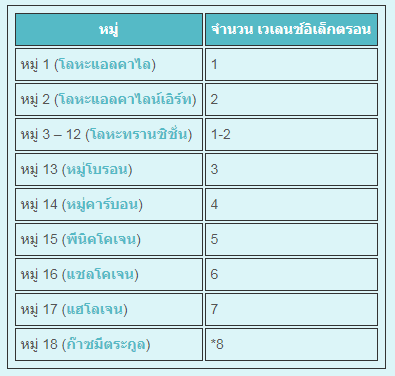
หมู่ธาตุที่มีเครื่องหมาย(*) ใช้แสดงว่าธาตุในหมู่ 18 ก๊าซมีกระกูล มีเวเลนซ์อิเล็กตรอน 8 ยกเว้น ฮีเลียม (He), มี 2
 ตารางธาตุจัดแบ่งเป็น 18 หมู่ เม่อพิจารณาสมบัติของธาตุต่างๆในแต่ละหมู่พบว่า 2 หมู่ด้านซ้ายมือสุดของตารางธาตุมีสมบัติเป็นโลหะ เรียกว่า หมู่ 1A และ 2A ส่วน 2 หมู่ด้านขวามือสุดของตารางธาตุมีสมบัติเป็น อโลหะ เรียกว่า หมู่ 7A และ 8A ส่วนธาตุในหมู่ 3A ถึง 6A มีทั้งธาตุที่เป็น อโลหะ เช่น คาร์บอน (C) ไนโตรเจน (N) ออกซิเจน (O) และ ธาตุกึ่งโลหะ เช่น โบรอน (B) และซิลิคอน (Si) เป็นต้น ส่วน 10 หมู่ที่อยู่ตรงกลางของตารางธาตุ มีสมบัติทางกายภาพเหมือนโลหะ แต่มีสมบัติทางเคมีบางประการที่ต่างจากโลหะในหมู่ 1A และ 2A นักวิทยาศาสตร์จึงจัดแยกไว้ต่างหาก และเรียกธาตุใน 10 หมู่นี้ว่า โลหะแทรนซิชัน (transition metal) ตารางธาตุจัดแบ่งเป็น 18 หมู่ เม่อพิจารณาสมบัติของธาตุต่างๆในแต่ละหมู่พบว่า 2 หมู่ด้านซ้ายมือสุดของตารางธาตุมีสมบัติเป็นโลหะ เรียกว่า หมู่ 1A และ 2A ส่วน 2 หมู่ด้านขวามือสุดของตารางธาตุมีสมบัติเป็น อโลหะ เรียกว่า หมู่ 7A และ 8A ส่วนธาตุในหมู่ 3A ถึง 6A มีทั้งธาตุที่เป็น อโลหะ เช่น คาร์บอน (C) ไนโตรเจน (N) ออกซิเจน (O) และ ธาตุกึ่งโลหะ เช่น โบรอน (B) และซิลิคอน (Si) เป็นต้น ส่วน 10 หมู่ที่อยู่ตรงกลางของตารางธาตุ มีสมบัติทางกายภาพเหมือนโลหะ แต่มีสมบัติทางเคมีบางประการที่ต่างจากโลหะในหมู่ 1A และ 2A นักวิทยาศาสตร์จึงจัดแยกไว้ต่างหาก และเรียกธาตุใน 10 หมู่นี้ว่า โลหะแทรนซิชัน (transition metal)
ความสัมพันธ์ระหว่างจำนวนธาตุในคาบต่างๆ กัลอิเล็กตรอนในระดับพลังงานต่างๆ
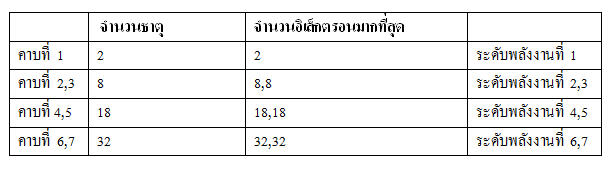
 เมื่อพิจารณาตารางธาตุจะเห็นว่า หมู่ 1A มีทั้งหมด 7 ธาตุ ซึ่งมีเลขอะตอมเป็น 1,3,11,19,37,55 และ 87 ถ้านักเรียนจัดอิเล็กตรอนของแต่ละธาตุเข้าในระดับพลังงานต่างๆ ตามหลักเกณฑ์ในตาราง 5.2 จะพบว่า ระดับพลังงานนอกสุดของทุกธาตุในหมู่ 1A มีอิเล็กตรอน 1 อนุภาคเหมือนกันหมด เรียกว่าธาตุในหมู่ 1A มีเวเลนซ์อิเล็กตรอนเท่ากับ 1 ในทำนองเดียวกัน ถ้านักเรียนจัดอิเล็กตรอนของธาตุต่างๆ ในหมู่ 2A ก็จะพบว่าธาตุในหมู่นี้ต่างก๊มีเวเลนซ์อิเล็กตรอนเป็น 2 และหมู่ 3A มีเวเลนซ์อิเล็กตรอนเป็น 3 เรื่อยไปจนถึงหมู่ 8A ก็มีเวเลนซ์อิเล็กตรอนเป็น 8 นั่นคือ จำนวนเวเลนซ์อิเล็กตรอนของธาตุในหมู่ 1A - 8A มีค่าตรงกับตัวเลขของหมู่นั้นๆ เมื่อพิจารณาตารางธาตุจะเห็นว่า หมู่ 1A มีทั้งหมด 7 ธาตุ ซึ่งมีเลขอะตอมเป็น 1,3,11,19,37,55 และ 87 ถ้านักเรียนจัดอิเล็กตรอนของแต่ละธาตุเข้าในระดับพลังงานต่างๆ ตามหลักเกณฑ์ในตาราง 5.2 จะพบว่า ระดับพลังงานนอกสุดของทุกธาตุในหมู่ 1A มีอิเล็กตรอน 1 อนุภาคเหมือนกันหมด เรียกว่าธาตุในหมู่ 1A มีเวเลนซ์อิเล็กตรอนเท่ากับ 1 ในทำนองเดียวกัน ถ้านักเรียนจัดอิเล็กตรอนของธาตุต่างๆ ในหมู่ 2A ก็จะพบว่าธาตุในหมู่นี้ต่างก๊มีเวเลนซ์อิเล็กตรอนเป็น 2 และหมู่ 3A มีเวเลนซ์อิเล็กตรอนเป็น 3 เรื่อยไปจนถึงหมู่ 8A ก็มีเวเลนซ์อิเล็กตรอนเป็น 8 นั่นคือ จำนวนเวเลนซ์อิเล็กตรอนของธาตุในหมู่ 1A - 8A มีค่าตรงกับตัวเลขของหมู่นั้นๆ

 https://wongdet.wordpress.com/66-2/ https://wongdet.wordpress.com/66-2/
 http://www.vcharkarn.com/lesson/1065 http://www.vcharkarn.com/lesson/1065

|

