
ทฤษฎีออร์บิทัลโมเลกุล(molecular orbital theory ; MO theory )
 ทฤษฎีออร์บิทัลโมเลกุลป็นทฤษฎีที่ใช้อธิบายว่าทั้งโมเลกุลและอะตอม ต่างก็มีออร์บิทัลซึ่งเป็นที่ที่อิเล็กตรอนสามารถเข้ามาอยู่ได้ โดยแต่ละออร์บิทัลมีพลังงานต่างกันไป หลักการสำคัญของทฤษฎีออร์บิทัลโมเลกุลจะมองว่าอิเล็กตรอนในออร์บิทัลโมเลกุลไม่ได้อยู่ประจำที่ ( delocalized electrons ) แต่สามารถเคลื่อนที่ไปได้ทั่วทั้งโมเลกุล ทฤษฎีออร์บิทัลโมเลกุลป็นทฤษฎีที่ใช้อธิบายว่าทั้งโมเลกุลและอะตอม ต่างก็มีออร์บิทัลซึ่งเป็นที่ที่อิเล็กตรอนสามารถเข้ามาอยู่ได้ โดยแต่ละออร์บิทัลมีพลังงานต่างกันไป หลักการสำคัญของทฤษฎีออร์บิทัลโมเลกุลจะมองว่าอิเล็กตรอนในออร์บิทัลโมเลกุลไม่ได้อยู่ประจำที่ ( delocalized electrons ) แต่สามารถเคลื่อนที่ไปได้ทั่วทั้งโมเลกุล

ข้อดี ของทฤษฎีออร์บิทัลโมเลกุลสามารถทำนายการเกิดเป็นโมเลกุล สมบัติทางแม่เหล็ก และให้ความเข้าใจเกี่ยวกับสภาวะเร้าของโมเลกุล
การซ้อนเหลื่อมกันของออร์บิทัลอะตอม ทำให้เกิดออร์บิทัลโมเลกุลซึ่งแบ่งได้เป็น 2 แบบ คือ
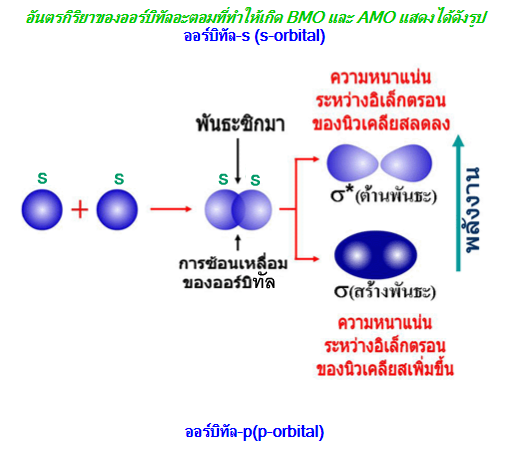
 1. ออร์บิทัลโมเลกุลแบบสร้างพันธะ (bonding molecular orbital ; BMO) การเกิดออร์บิทัลโมเลกุลแบบนี้จะทำให้อิเล็กตรอนมีพลังงานลดลงนั่นคือมีความเสถียรมากขึ้น 1. ออร์บิทัลโมเลกุลแบบสร้างพันธะ (bonding molecular orbital ; BMO) การเกิดออร์บิทัลโมเลกุลแบบนี้จะทำให้อิเล็กตรอนมีพลังงานลดลงนั่นคือมีความเสถียรมากขึ้น
 2. ออร์บิทัลโมเลกุลแบบต้านพันธะ (anti-bonding molecular orbital ; AMO)การเกิดออร์บิทัลโมเลกุลแบบนี้จะทำให้อะตอมที่ได้มีพลังงานเพิ่มขึ้นนั่นคือมีความเสถียรน้อยลง 2. ออร์บิทัลโมเลกุลแบบต้านพันธะ (anti-bonding molecular orbital ; AMO)การเกิดออร์บิทัลโมเลกุลแบบนี้จะทำให้อะตอมที่ได้มีพลังงานเพิ่มขึ้นนั่นคือมีความเสถียรน้อยลง
ออร์บิทัล-p(p-orbital)
ก. ซ้อนเหลื่อมตามแนวปลาย
ข. ซ้อนเหลื่อมตามแนวข้าง
จากรูปแสดงการเกิดออร์บิทัลโมเลกุลิดจากการซ้อนเหลื่อมกันของออร์บิทัล-p
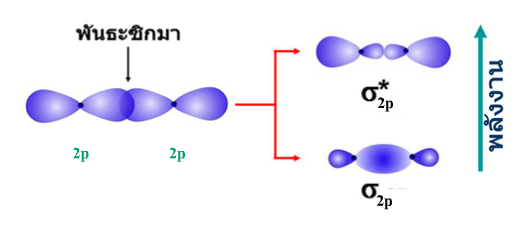
 ก.ออร์บิทัล-p ทั้งสองเกิดการซ้อนเหลื่อมตามแนวปลายเกิดเป็นพันธะซิกมา ( σ-bond) ก.ออร์บิทัล-p ทั้งสองเกิดการซ้อนเหลื่อมตามแนวปลายเกิดเป็นพันธะซิกมา ( σ-bond)
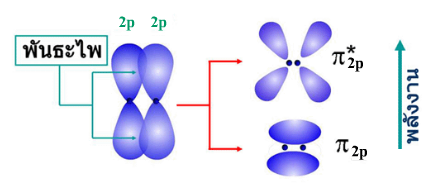
 ข.ออร์บิทัล-p ทั้งสองเกิดการซ้อนเหลื่อมตามแนวข้างเกิดเป็นพันธะไพ ข.ออร์บิทัล-p ทั้งสองเกิดการซ้อนเหลื่อมตามแนวข้างเกิดเป็นพันธะไพ  " "
จากรูปจะเห็นว่าออร์บิทัลโมเลกุลแบบสร้างพันธะจะมีพลังงานต่ำกว่าแบบต้านพันธะเสมอ (* หมายถึงต้านพันธะ)
 BMO และ AMO ที่ได้จากการรวมกันของออร์บิทัล-s จะแทนด้วยสัญลักษณ์ σs และ σ* sตามลำดับ BMO และ AMO ที่ได้จากการรวมกันของออร์บิทัล-s จะแทนด้วยสัญลักษณ์ σs และ σ* sตามลำดับ
 BMO และ AMO ที่ได้จากการรวมกันของออร์บิทัล-p จะแทนด้วยสัญลักษณ์ σz, σ* z, BMO และ AMO ที่ได้จากการรวมกันของออร์บิทัล-p จะแทนด้วยสัญลักษณ์ σz, σ* z, 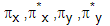
เมื่อ pz เกิดการซ้อนเหลื่อมตามแนวปลาย 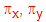 เกิดการซ้อนเหลื่อมตามแนวข้าง เกิดการซ้อนเหลื่อมตามแนวข้าง

 http://www.il.mahidol.ac.th/e-media/ap-chemistry1/chemical_bonding/covalent2.htm http://www.il.mahidol.ac.th/e-media/ap-chemistry1/chemical_bonding/covalent2.htm

|

