
 จุดเดือดของธาตุหรือสสารเป็นอุณหภูมิซึ่งความดันไอของของเหลวเท่ากับความดันของสิ่งแวดล้อมที่อยู่รอบของเหลวนั้น ของเหลวในสิ่งแวดล้อมที่เป็นสุญญากาศมีจุดเดือดต่ำกว่าของเหลวที่ความดันบรรยากาศของเหลวในสิ่งแวดล้อมความดันสูงจะมีจุดเดือด สูงกว่าของเหลวที่ความดันบรรยากาศ จึงอาจกล่าวได้ว่า จุดเดือดของของเหลวมีได้หลากหลายขึ้นอยู่กับความดันของสิ่งแวดล้อม (ซึ่งมักแตกต่างกันไปตามความสูง) ในความดันเท่ากัน ของเหลวต่างชนิดกันย่อมเดือดที่อุณหภูมิต่างกัน จุดเดือดของธาตุหรือสสารเป็นอุณหภูมิซึ่งความดันไอของของเหลวเท่ากับความดันของสิ่งแวดล้อมที่อยู่รอบของเหลวนั้น ของเหลวในสิ่งแวดล้อมที่เป็นสุญญากาศมีจุดเดือดต่ำกว่าของเหลวที่ความดันบรรยากาศของเหลวในสิ่งแวดล้อมความดันสูงจะมีจุดเดือด สูงกว่าของเหลวที่ความดันบรรยากาศ จึงอาจกล่าวได้ว่า จุดเดือดของของเหลวมีได้หลากหลายขึ้นอยู่กับความดันของสิ่งแวดล้อม (ซึ่งมักแตกต่างกันไปตามความสูง) ในความดันเท่ากัน ของเหลวต่างชนิดกันย่อมเดือดที่อุณหภูมิต่างกัน
จุดเดือดจุดหลอมเหลวของธาตุ ขึ้นอยู่กับแรงดึงดูดระหว่างโมเลกุลหรืออะตอม ถ้าแรงดึงดูดระหว่างโมเลกุลหรืออะตอมมาก จะมีจุดหลอมเหลวสูง แต่ถ้าแรงดึงดูดระหว่างโมเลกุลน้อย จุดเดือดจุดหลอมเหลวจะต่ำ
ธาตุโลหะ แรงดึงดูดระหว่างอะตอม เป็นพันธะโลหะ มีจุดเดือดจุดหลอมเหลวสูง ความแข็งแรงของพันธะโลหะขึ้นอยู่กับขนาดของอะตอม
-ถ้าอะตอมมีขนาดเล็กพันธะโลหะจะมีความแข็งแรงมากกว่าขนาดอะตอมใหญ่
-ธาตุที่มีระดับพลังงานเท่ากัน ความแรงของพันธะโลหะขึ้นอยู่กับจำนวนเวเลนซ์อิเล็กตรอน คือ โลหะที่มีจำนวนเวเลนซ์อิเล็กตรอนมากกว่าจะมีความแรงของพันธะโลหะมากกว่า โลหะใดมีความแรงของพันธะโลหะมาก จุดเดือดจุดหลอมเหลวก็จะสูงและถ้าโลหะใดมีความแรงของพันธะโลหะน้อย มาก จุดเดือดจุดหลอมเหลวก็จะต่ำด้วย
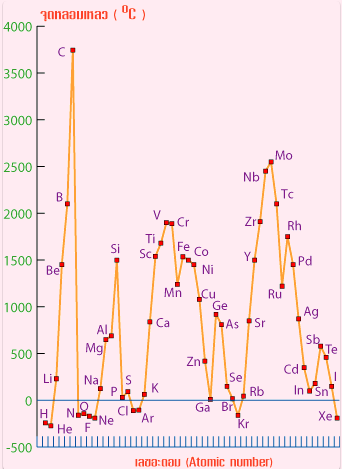
รูปที่ 1 กราฟจุดเดือดจุดหลอมเหลวของธาตุในตารางธาตุ
จากกราฟแนวโน้มจุดเดือดจุดหลอมเหลวของธาตุในหมู่เดียวกัน จากบนลงล่าง เป็นดังนี้
1. ธาตุที่เป็นโลหะ
- จุดเดือดจุดหลอมเหลวลดลงเมื่อเลขอะตอมเพิ่มขึ้นเนื่องจากขนาดอะตอมมีขนาดใหญ่ขึ้น
-โลหะทุกชนิดมีจุดเดือดจุดหลอมเหลวกว้าง คือห่างกันมาก
2. ธาตุเป็นอโลหะ
- จุดเดือดจุดหลอมเหลวเพิ่มขึ้นเมื่อเลขอะตอมลดลง เนื่องจากมวลอะตอมมีค่าเพิ่มขึ้น ทำให้แรงดึงดูดระหว่างโมเลกุลเพิ่มขึ้น
- อโลหะทุกชนิดมีจุดเดือดจุดหลอมเหลว คือห่างกันน้อย เช่น Cl มีจุดเดือดห่างจากจุดหลอมเหลว-จุดเดือดจุดหลอมเหลวของธาตุในหมู่ IA IIA IIIA และ IVA เป็นโลหะ ยึดเหนี่ยวดัวยพันธะโลหะ มีแนวโน้มสูงขึ้นตามลำดับ โดยเฉพาะหมู่ IVA จะมีจุดเดือดจุดหลอมเหลวสูงที่สุด เมื่อเลขอะตอมเพิ่มขึ้น จะมีเวเลนซ์อิเล็กตรอนมากขึ้น มีแรงยึดเหนี่ยวระหว่างนิวเคลียสกับเวเลนซ์อิเล็กตรอนที่เคลื่อนที่อิสระแข็งแรงขึ้น ธาตุหมู่ IVA บางธาตุมีโครงสร้างเป็นผลึกร่างตาข่ายจึงทำให้มีจุดเดือดจุดหลอมเหลวสูง
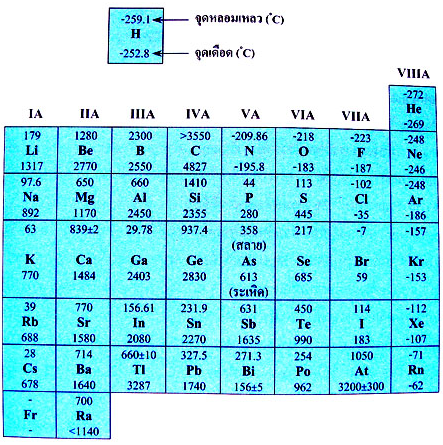
รูปที่ 2 ตารางจุดเดือดจุดหลอมเหลวของธาตุในตารางธาตุ
- หมู่ VA VIA VIIA VIIIA เป็นอโลหะยึดเหนี่ยวกันด้วยแรงแวนเดอร์วาลส์ มีจุดเดือดจุดหลอมเหลวต่ำ เนื่องจากแรงยึดเหนี่ยวระหว่างโมเลกุลของธาตุกลุ่มนี้มีค่าต่ำมาก
- ธาตุที่มีความเป็นโลหะกับอโลหะปนกันเรียกว่ากึ่งโลหะมี 8 ตุ คือ B, Si, Ge, As, Sb, Te, Po และ At

 https://th.wikipedia.org/wiki/จุดเดือด https://th.wikipedia.org/wiki/จุดเดือด
https://dangwansri.wordpress.com/หน้าแรก/กิจกรรม-2/
|

